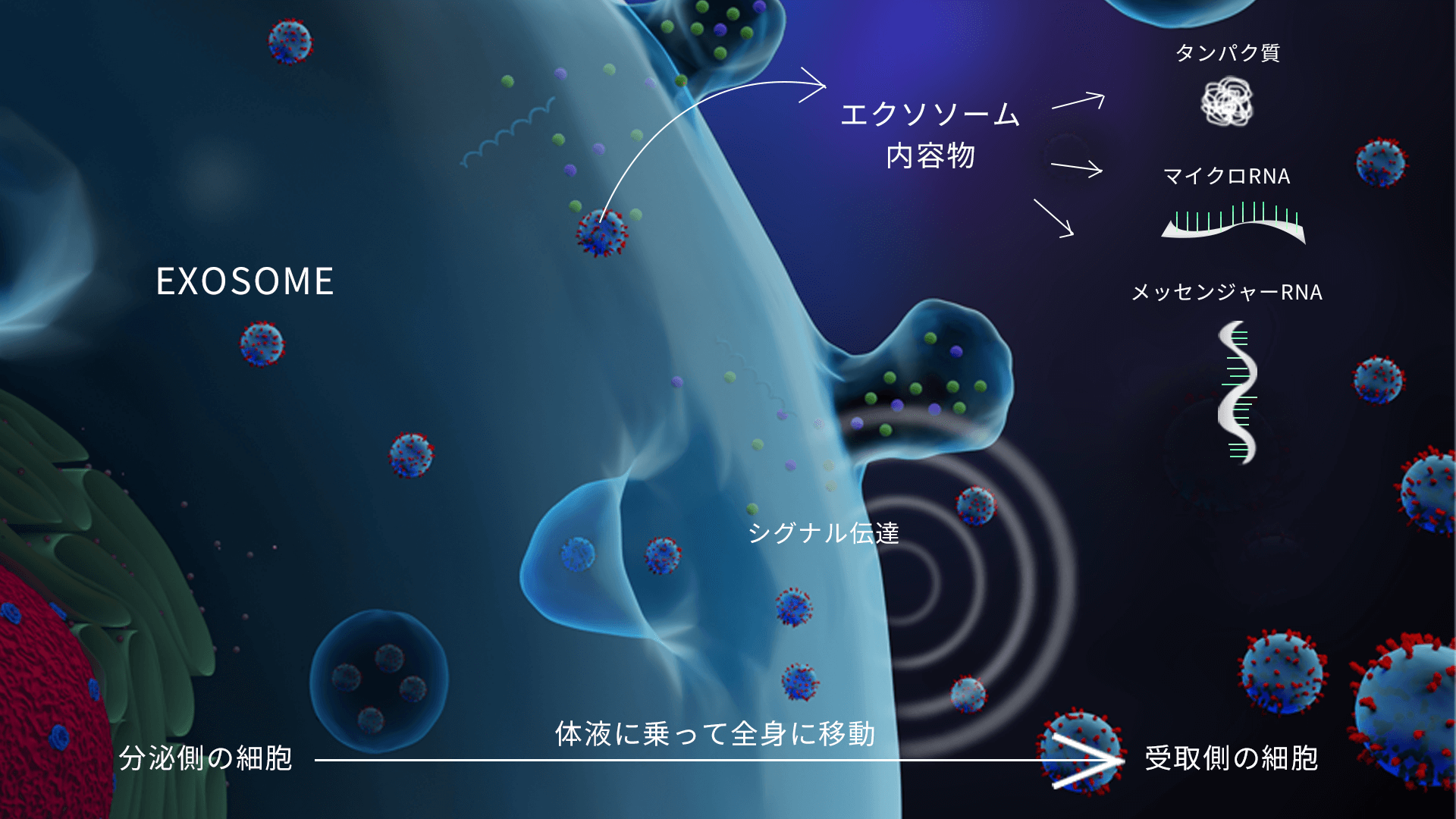
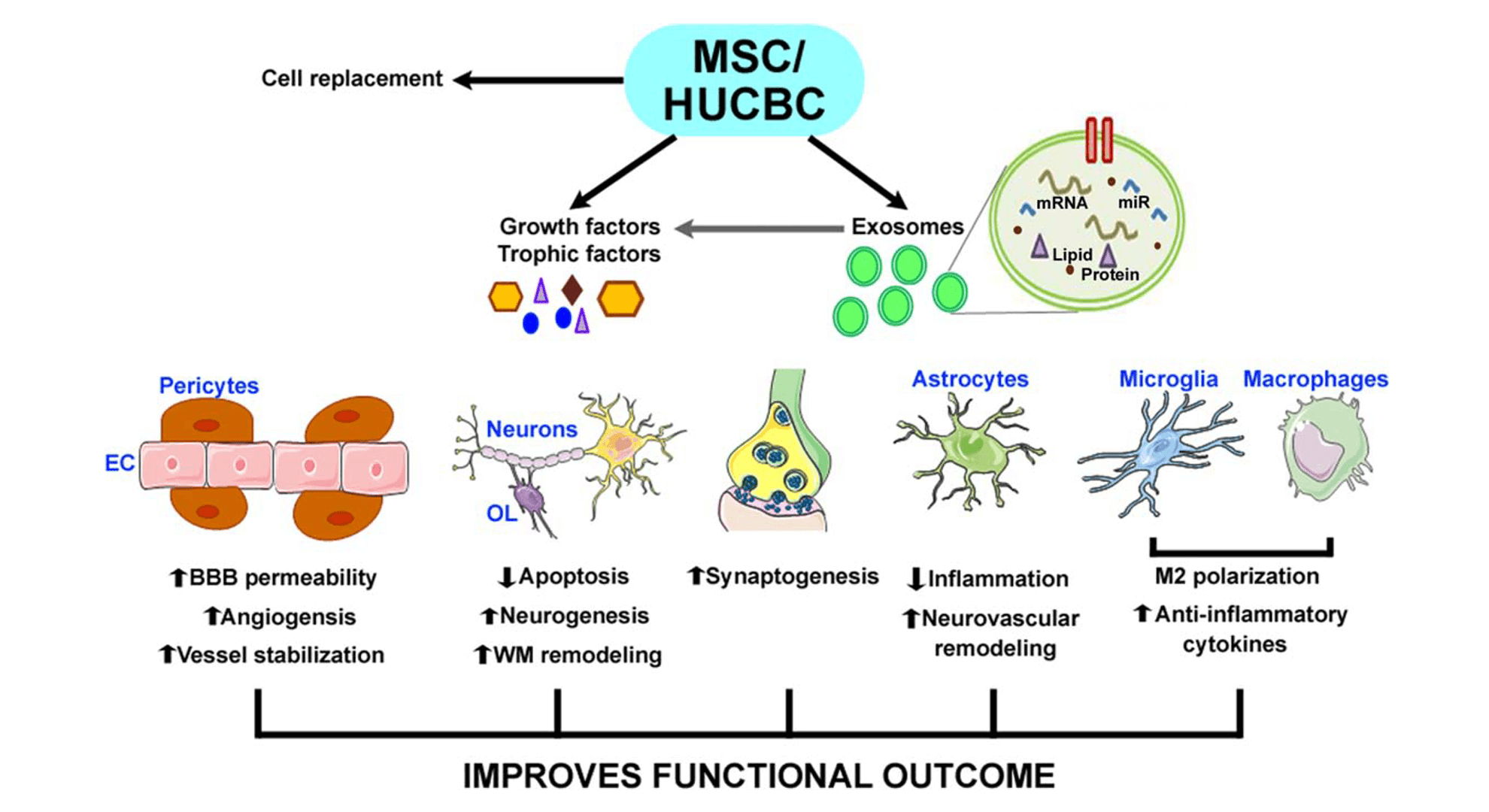
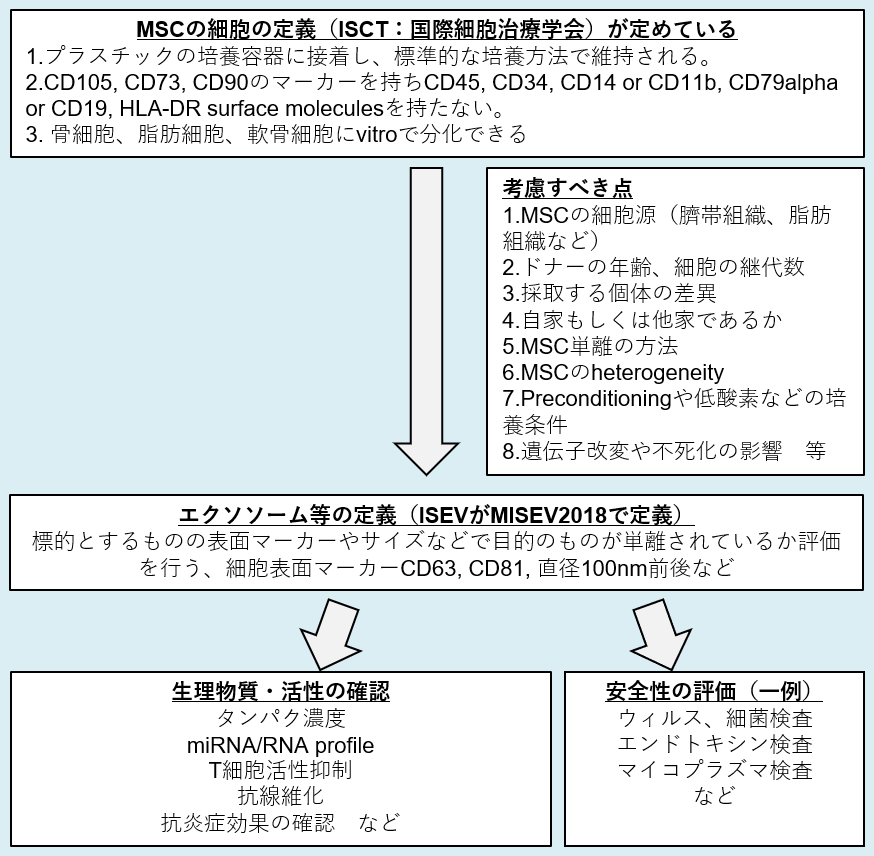
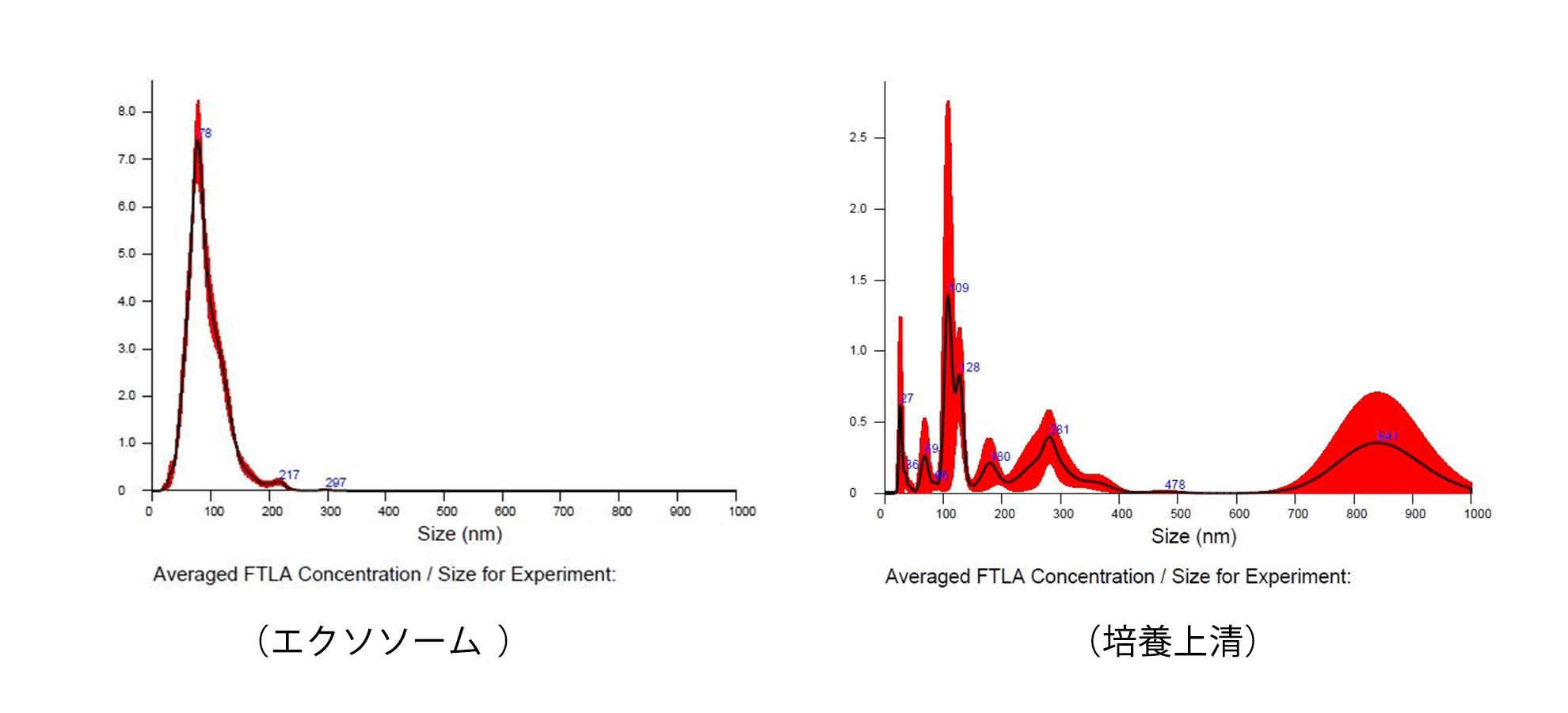
外泌体的机制
外泌体内部包含一种称为“微小RNA(microRNA)”的短链基因序列。
这些microRNA中携带着简洁明了的遗传信息,被认为正是干细胞发挥疗效的关键所在。
根据美国加州大学圣地亚哥分校(UC San Diego)的研究报告指出:“即使去除细胞核,干细胞仍可展现相同的药理效果”,
这说明干细胞的药理作用主要来自于外泌体等胞外囊泡(EV)本身。
此外,外泌体源自细胞、为天然成分,人体内本就大量存在,
因此副作用风险较低,且与传统的细胞治疗相比,正逐渐被认为具有更高的安全性与治疗优势。